抗体的酶标记方法及标记效果测定
1.标记方法 良好的酶结合物取决于两个条件:即高效价的抗体和高活性的酶。抗体的活性和纯度对制备标记抗体至关重要,因为特异性免疫反应随抗体活性和纯度的增加而增强。在酶标记过程中,抗体的活性有所降低,故需要纯度高、效价高及抗原亲和力强的抗体球蛋白,*好使用亲和层析提纯的抗体,可提高敏感性,而且可稀释使用,减少非特异性吸附。
酶与抗体交联,常用戊二醛法和过碘酸盐氧化法。郭春祥建立的HRP标记抗体的改良过碘酸钠法简单易行,标记效果好,特别适用于实验室的小批量制备。其标记程序为:将5μg HRP溶于0.5ml蒸馏水中,加入新鲜配制的0.06 mol/L的过碘酸钠(NaIO4)水溶液0.5ml,混匀置4℃冰箱30分钟 , 取出加入0.16mol/L的乙二醇水溶液0.5ml,室温放置30分钟后加入含5(g纯化抗体的水溶液1ml,混匀并装透析袋,以0.05mol/L、pH9.5的碳酸盐缓冲液于4℃冰箱中慢慢搅拌透析6小时(或过夜)使之结合,然后吸出,加硼氢化钠(NaBH4)溶液( 5(g/ml)0.2ml,置4℃冰箱2小时,将上述结合物混合液加入等体积饱和硫酸铵溶液,置4℃冰箱30分钟后离心,将所得沉淀物溶于少许0.02mol/L、pH7.4PBS中,并对之透析过夜(4℃),次日离心除去不溶物,即得到酶标抗体,用0.02mol/L、pH7.4PBS稀至5ml,进行测定后,冷冻干燥或低温保存。
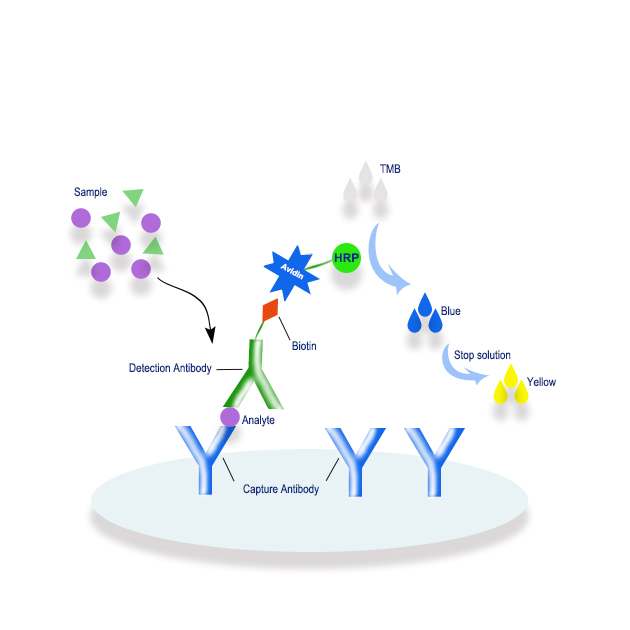
2.酶标抗体标记效果测定:测定内容包括酶和抗体活性、结合物中酶含量和IgG含量、酶与IgG摩尔比值以及结合率。
(1) 酶与抗体的活性 常用琼脂扩散或免疫电泳法,使抗原与抗体形成沉淀线,经PBS漂洗1天,再以蒸馏水浸泡1小时,将琼脂凝胶片浸于酶底物溶液中着色,如果出现应有的颜色反应,再用生理盐水浸泡,颜色仍然不褪,表示结合物既有酶的活性,也有抗体活性。良好的结合物在显色后,琼扩滴度应在1:16以上。另一个测定方法是用系列稀释的酶标抗体直接以ELISA(酶联免疫吸附试验,酶联免疫试剂盒)方法进行方阵滴定,此法不仅可以测定标记效果,还可以确定酶标抗体的使用浓度。
(2) 结合物的定量测定 一般是对结合物中的酶和IgG进行定量测定。常用紫外分光光度计于403nm和280nm进行测定,然后按下列公式计算:
酶量(mg/ml)=OD403×0.42
IgG量(mg/ml)=(OD280-OD403×0.4)×0.94×0.62
对于过碘酸钠氧化法制备的标记抗体量,按下列公式计算:
IgG量(mg/ml)=(OD280-OD403×0.34)×0.62
已知酶量和IgG量后,即可计算出标记抗体的摩尔(mol)比值。
HRP/IgG摩尔比值=HRP(mg/ml)/IgG(mg/ml)×4
结合物中酶总量=HRP(mg/ml)×结合物溶液量
结合物产率=结合物中酶总量/标记时加入的酶量×100%
用于ELISA(酶联免疫吸附试验,酶联免疫试剂盒)的结合物的酶量为400(g/ml时效果一般,为500(g/ml时效果较好,达 1000(g/ml时效果*好。mol.比值由于结合物中含的IgG并不完全可靠,所以不能作为主要参数。一般认为mol.比值为0.7时效果一般,1.0时效果较好,1.5-2.0时*好。酶结合率为 7%时效果一般,为9%-10%较好,达30%以上时*好。(四) ELISA(酶联免疫吸附试验,酶联免疫试剂盒)方法的基本类型、用途及操作程序

