| 产品名称 | 检测方法 | 规格 | 货号 |
| 单胺氧化酶(Monoamine Oxidase,MAO)试剂盒 | 分光光度法 | 50管/48样 | CS-01S63409 |
MAO(EC
测定原理
MAO催化单胺类底物脱氨生成相应的醛,进一步氧化成酸;底物在360nm处有特征吸收峰,测定360nm光吸收下降的速率,计算MAO活性。
自备实验用品及仪器
天平、低温离心机、可见分光光度计、1 mL玻璃比色皿、蒸馏水。
试剂组成和配制
提取液一:液体50mL×1瓶,4℃保存。
提取液二:液体50mL×1瓶,4℃保存。
试剂一:液体100mL×1瓶,4℃保存。
试剂二:液体5mL×1瓶,4℃避光保存。
粗酶液提取
1.组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液一)进行冰浴匀浆,10000g,4℃,离心10min,弃沉淀;把上清转移到另一预冷的离心管,10000g,4℃,离心30min,弃上清;加入1.0 mL预冷的提取液二,震荡混匀,16000g,4℃,离心40min,弃上清;沉淀加入预冷的1.0 mL 试剂一,震荡混匀,即粗酶液(可用于可溶性蛋白浓度测定)取上清置于冰上待测。
2.细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后10000g,4℃,离心10min,弃沉淀;把上清转移到另一预冷的离心管,10000g,4℃,离心30min,弃上清;加入1.0 mL预冷的提取液二,震荡混匀,16000g,4℃,离心40min,弃上清;沉淀加入预冷的1.0 mL 试剂一,震荡混匀,即粗酶液(可用于可溶性蛋白浓度测定),取上清置于冰上待测。
3.血清:直接测定。
测定操作表
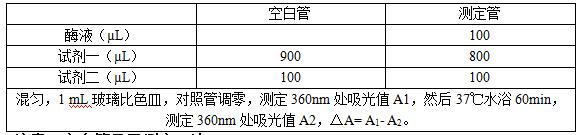
注意:空白管只需测定一次。
MAO活性计算公式
1、按蛋白含量计算
酶活定义:37℃,pH7.6时,每毫克蛋白质1min内转化1nmol底物的酶量为一个酶活单位。
DAO活性(nmol/min / mg prot)= ×V反总÷(V样×Cpr)÷T= 114×ΔA÷Cpr
2、按样本质量计算
酶活定义:37℃,pH7.6时,每克样品1min内转化1nmol底物的酶量为一个酶活单位。
DAO活性(nmol/min / g 鲜重)=×V反总÷(V样÷V样总×W)÷T = 114×ΔA÷ W
3、按照细胞数量计算
酶活定义:37℃,pH7.6时,每104 个细胞1min内转化1nmol底物的酶量为一个酶活单位。
DAO活性(nmol/min / 104 cell)= ×V反总÷(V样÷V样总×细胞数量)÷T
= 114×ΔA÷细胞数量
4、按照液体体积计算
酶活定义:37℃,pH7.6时,每升血清1min内转化1nmol底物的酶量为一个酶活单位。
DAO活性(nmol/min /L)=×V反总÷V样=114000×ΔA
ε:底物摩尔消光系数,1.46 L/mol /cm;d:比色皿光径,1cm;V反总:反应总体积,1mL;V样:反应中样本体积,0.1mL;V样总:加入提取液体积,1mL;Cpr:样本蛋白浓度,mg/mL;T:反应时间,60min,W:样本质量,g
注意事项
1、吸光度变化应该控制在0.01~0.8之间。否则加大样品量或稀释样品,注意计算公式中参与计算的稀释倍数要相应改变。
2、样品蛋白质含量需要另外测定。
联系人:高小姐
手 机:13585831301
Q Q:3004967995
座 机:021-59541103
传 真:021-60443211
地 址:上海嘉定区嘉罗公路1661