| 产品名称 | 检测方法 | 规格 | 货号 |
| 线粒体复合体Ⅴ试剂盒 | 分光光度法 | 25管/12样 | CS-01S63506 |
线粒体复合体Ⅴ又称F1F0-ATP合酶,广泛存在于动物、植物、微生物和培养细胞的线粒体中,由F1和F0两个亚单位组成。该酶利用呼吸链产生的质子电化学梯度催化ATP合成,也可逆过程水解ATP。此外,复合体Ⅴ还存在于叶绿体、异养菌和光合细菌中。复合体Ⅴ是线粒体氧化磷酸化和叶绿体光合磷酸化合成ATP的关键酶。
测定原理
复合体Ⅴ水解ATP产生ADP和Pi,通过测定Pi增加速率来测定复合体Ⅴ活性。
需自备的仪器和用品
可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
试剂的组成和配制
试剂一:25mL×1瓶,-20℃保存;
试剂二:25mL×1瓶,-20℃保存;
试剂三:1 mL×1瓶,-20℃保存;
试剂四:粉剂×1支,-20℃保存;临用前每支加入1.3mL蒸馏水,充分溶解备用,用不完的试剂仍-20℃保存;
试剂五:6mL×1瓶,4℃保存;
试剂六:粉剂×1瓶,4℃保存;临用前加入3mL蒸馏水,充分混匀;溶解后4℃保存一周;
试剂七:粉剂×1瓶, 4℃保存;临用前加入10mL蒸馏水,充分混匀;溶解后4℃保存一周;
试剂八:粉剂×1瓶, 4℃保存;临用前加入10mL蒸馏水,充分混匀;溶解后4℃保存一周;
试剂九:液体10mL×1 瓶,室温保存。
定磷试剂的配制:按H2O: 试剂七:试剂八:试剂九=2:1:1:1 的比例配制,配好的定磷试剂应为浅黄色。若无色则试剂失效,若是蓝色则为磷污染(请根据需要,用多少配多少)。
注意:配试剂*好用新的烧杯、玻棒和玻璃移液器,或者一次性塑料器皿,以避免磷污染。
样本的前处理:
组织、细菌或细胞中胞浆蛋白与线粒体蛋白的分离:
①准确称取0.1g组织或收集500万细菌或细胞,加入1mL试剂一和10uL 试剂三,用冰浴匀浆器或研钵匀浆。
②将匀浆600g,4℃离心5min。
③弃沉淀,将上清液移至另一离心管中,11000g,4℃离心10min。
④上清液即为除去线粒体的胞浆蛋白,可用于测定从线粒体泄漏的复合体Ⅴ(此步可选做)。
⑤步骤④中的沉淀即为线粒体,加入800uL试剂二和8uL 试剂三,超声波破碎(冰浴,功率20%或200W,超声3s,间隔10秒,重复30次),用于复合体Ⅴ酶活性测定。
测定步骤
1、酶促反应
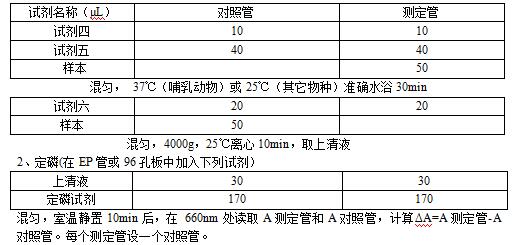
复合体Ⅴ活性计算
标准条件下测定的回归方程为y = 1.274x + 0.004;x为标准品浓度(mmol/L),y为A值。
1、组织中复合体Ⅴ活性的计算:
(1) 按样本蛋白浓度计算
单位的定义:每mg组织蛋白每分钟产生1 nmol 无机磷定义为一个酶活性单位。
复合体Ⅴ活性(nmol/min/mg prot)=[(ΔA-0.004) ÷1.274×V反总×106]÷(V样×Cpr) ÷T
=62.8× (ΔA-0.004) ÷Cpr
此法需要自行测定样本蛋白质浓度。
(2) 按样本鲜重计算
单位的定义:每g组织每分钟产生1 nmol 无机磷定义为一个酶活性单位。
复合体Ⅴ活性(nmol/min /g 鲜重)=[(ΔA-0.004) ÷1.274×V反总×106]÷(W× V样÷V样总) ÷T =50.7× (ΔA-0.004) ÷W
(3) 按细菌或细胞密度计算
单位的定义:每1万个细菌或细胞每分钟产生1 nmol 无机磷定义为一个酶活性单位。
复合体Ⅴ活性(nmol/min /104 cell)=[(ΔA-0.004) ÷1.274×V反总×106]÷(500×V样÷V样总) ÷T=0.101× (ΔA-0.004)
V反总:反应体系总体积,3×10-4 L; V样:加入样本体积,0.125 mL;V样总:加入提取液体积,0.808 mL;T:反应时间,30 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细胞或细菌总数,500万。
标签:线粒体复合体Ⅴ试剂盒
联系人:高小姐
手 机:13585831301
Q Q:3004967995
座 机:021-59541103
传 真:021-60443211
地 址:上海嘉定区嘉罗公路1661